





|
2004.04【特集記事−本誌編集部より−】 医療機器規格ISO 13485 −改正薬事法で対応必至− |
|||||||||||||||||||||||||||||||||||||||||||||||
|
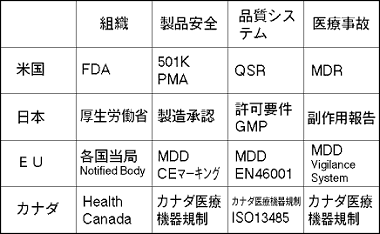
ISO 13485は、ISO 9001をベースとした医療機器に関する追加要求事項を加えた品質マネジメントシステムのセクター規格です。1996年に誕生し、2003年7月にISO 13485:2003が正式にISO規格として発行されました。ヨーロッパへの医療機器輸出企業は、医用機器指定(MDD)への適合のためにすでにISO 13485が必須となっています。 2002年に公布されて2005年に施行される予定の改正薬事法においても、医療機器に関わる品質システム要求事項の内容はISO 13485:2003が骨格になると予定されています。 世界的に普及したISO 9000シリーズを、医療機器に適用する場合、その要求事項のみでは不十分であるとの国際的な共通認識から、医療機器の品質管理の分野における要求事項の標準化と指針作成のためISO/TC 210が設立されました。1994年、ワシントンで第1回会議が開催され、1996年、ISO 9001:1994及びISO 9002:1994を基にして、次の規格が発行されました。
我が国は、ISO 13485及びISO 13488の作成に積極的に参画してきました。1998年、それらを基にして国際一致規格JIS Q 13485及びJIS Q 13488が制定。 10年間以上にわたる利用の実績と、問題点及び改善要望の調査分析を基に、ISO 9000シリーズは大幅に改正され、2000年12月、次の3種類のコア規格が発行されたのは皆様ご存じのとおりです。また、2002年、関連する監査の規格が発行されました。
なお、ISO 13485:2003のための指針ISO/TR 14969の審議が進められており、2004年前半に発行される予定でありましたが、まだDISに進む段階のようで発行が遅れそうです。 小センターでは、ISO 13485に対応するセミナー「医療機器ISO 13485入門講座」「医療機器ISO 13485実践講座」「医療機器ISO 13485内部監査員養成講座」を定期的に実施。実践的指導書として「医療機器ISO 13485:2003認証取得マニアル」を近刊の予定です。 次頁では、ISO 13485に関して皆様が確認しておきたいと思われるであろうことをQ & A形式でまとめてみました。
■医療機器ISO 13485 Q & A
 |
|||||||||||||||||||||||||||||||||||||||||||||||


